تاریخچه ISO 13485

وبلاگ

سیستم مدیریت کیفیت یا QMS، یک چهارچوب جامع یا مجموعهای از رویههای مستند است که افراد یک سازمان را هدایت میکند تا به طور مداوم محصولاتی را ارائه دهند که الزامات مشتری و مقررات را برآورده میکنند.
داشتن یک سیستم مدیریت کیفیت که الزامات هنجارها و استانداردهای قابل اجرا را برآورده کند، برای تولیدکنندگان تجهیزات پزشکی یک الزام نظارتی است. بنابراین، تولیدکنندگان نمیتوانند بدون آن، تجهیزات پزشکی خود را به طور قانونی وارد بازار کنند.
استاندارد ISO 13485 یک راهنمای جامع و مفید برای استقرار سیستم مدیریت کیفیت در صنعت تجهیزات پزشکی است که در این مقاله به بررسی پیشینه و تغییرات آن در طول سال های اخیر می پردازیم.
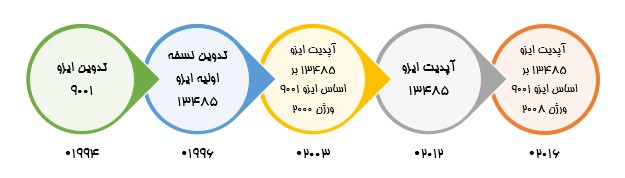
استاندارد ISO 13485 بر اساس چهارچوب استاندارد ISO 9001 اما برای پاسخ به نیازهای صنعت تجهیزات پزشکی معرفی شد. اولین نسخه آن در سال 1996 در سازمان بین المللی ISO تدوین شد. قبل از این تاریخ، فعالان حوزه صنعت برای دریافت مجوزهای قانونی خود از راهنماهای اختیاری و اجباری مختلف استفاده می کردند که به جغرافیای محل فعالیت ایشان مرتبط بود. از جمله استاندارد EN 46001 در اتحادیه اروپا. اما به تدریج و با تلاش سازمان بین المللی ISO و با هدف یکسان سازی مقررات نظارتی در بازارهای بین المللی، سیستم ها به سمت استقرار استاندارد ISO 13485 سوق پیدا کردند. لازم به ذکر است که دریافت گواهینامه ISO 13485 به معنی دریافت مجوز ورود به بازار های فروش نیست و در صنعت تجهیزات پزشکی همچنان الزامات قانونی و منطقه ای، نقش تعیین کننده ای در دریافت تاییدیه ها برای فعالیت در بازار توسط تولید کننده دارد.
استاندارد ISO 13485 چندین بهروزرسانی کلیدی را پشت سر گذاشته است، که شامل اصلاحات اساسی در سالهای ۲۰۰۳ و ۲۰۱۶ میشود و تمرکز آن را بر مدیریت ریسک و رعایت مقررات نظارتی نشان می دهد. این تکامل، تعهد صنعت به ایمنی بیمار و کیفیت محصول را برجسته میکند و ISO 13485 را به عنوان یک استاندارد حیاتی برای تولیدکنندگان تجهیزات پزشکی تثبیت میکند.
در ادامه به طور خلاصه تغییرات ورژن های مختلف این استاندارد بیان شده است:
در بخش تعاریف، عبارات زیر حذف شده است: – تجهیز پزشکی فعال – تجهیز پزشکی کاشتنی فعال عبارات زیر اضافه شده است: – نماینده مجاز – ارزیابی بالینی – شکایت – توزیع کننده – وارد کننده – چرخه عمر – تولید کننده – خانواده وسیله پزشکی – ارزیابی عملکرد – نظارت پس از عرضه به بازار – محصول – محصول خریداری شده – ریسک – مدیریت ریسک – سیستم محافظ سترون
|
اضافه شدن الزامات پرونده فنی محصول |
الزامات و استاندارد کنترل آلودگی محیط |
تکمیل الزامات ارتباطات (مشتری و مراجع قانونی – ارتباطات داخلی) |
اضافه شدن الزامات انتقال اطلاعات به تولید |
اضافه شدن استاندارد طراحی و توسعه محصول |
زیر بند مجزا برای پاکیزگی محصول |
الزامات صحه گذاری سترون و سیستم های محافظ سترون |
الزامات بررسی و پیگیری شکایات |
الزامات گزارش به مراجع قانونی |
الزامات کنترل محصول نامنطبق شامل: – الزامات عمومی – اقدامات لازم برای کنترل محصول نامنطبق قبل از فروش – اقدامات لازم برای کنترل محصول نامنطبق پس از فروش – بازکاری
|
تعاریف : – تجهیز پزشکی فعال – تجهیز پزشکی کاشتنی فعال – هشدار توصیه ای – شکایت مشتری – تجهیز پزشکی کاشتنی – برچسب گذاری – وسیله پزشکی – وسیله پزشکی سترون |
استانداردی برای پرونده فنی محصول وجود نداشت |
الزامات محیط کاری بدون کنترل آلودگی |
الزامات ارتباط با مشتری |
—— |
—— |
بدون زیر بند مجزا |
بدون فرآیند صحه گذاری |
بدون زیر بند مجزا |
بدون زیر بند مجزا |
الزامات کنترل محصول نامنطبق |
دیدگاهتان را بنویسید